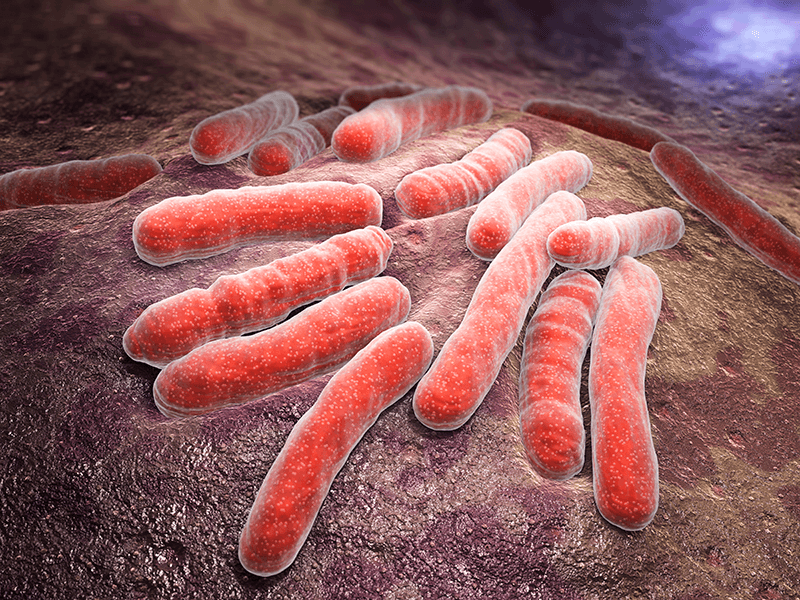
Bótox: la toxina botulínica producida por una bacteria
05/05/2017
Cajas inteligentes consiguen alargar la vida de la fruta
09/05/2017La dureza del agua es la concentración total de iones minerales que hay en una determinada cantidad de agua, principalmente, iones de magnesio y calcio (Ca2+ y Mg2+)
Un agua denominada comúnmente como “dura” tiene una elevada concentración de dichas sales y el agua “blanda” las contiene en muy poca cantidad.
La unidad de medida de la dureza más frecuente son los grados hidrométricos franceses (º H F)
El Real Decreto 140/2003, de 7 de febrero, por el que se establecen los criterios sanitarios de la calidad del agua de consumo humano, no establece ningún límite para la dureza, ya que la Organización Mundial de la Salud determina que tanto si la dureza del agua es alta o está en valores bajos no se produce ningún efecto pernicioso para la salud de las personas.
¿CÓMO SE GENERA LA DUREZA DEL AGUA?
La presencia de sales de magnesio y calcio en el agua depende fundamentalmente de las formaciones geológicas atravesadas por el agua de forma previa a su captación.
Las aguas subterráneas que atraviesan acuíferos carbonatados (calizas) son las que presentan mayor dureza y dichos acuíferos están formados por carbonatos de calcio y magnesio.
Las aguas subterráneas procedentes de acuíferos con composición eminentemente silicatada (p.e. granitos) dan lugar a un agua blanda, es decir, con cantidades muy bajas de sales de calcio y magnesio.
¿EN QUÉ INFLUYE LA DUREZA DEL AGUA EN NUESTRO DÍA A DÍA?
Un efecto muy visible en aguas de distinta dureza (un agua “dura y un agua “blanda”) es su diferente comportamiento ante la adición de jabón.
En presencia de la misma cantidad de jabón, la aparición de espuma es mucho menor si se trata del agua “dura”, ya que el calcio y el magnesio reaccionan con los compuestos que forman el jabón y dejan de ser efectivos, con la consiguiente necesidad de añadir más cantidad de jabón si nos encontramos en este extremo.
El efecto más conocido en lugares en los que el agua de abastecimiento presenta una elevada dureza es la formación de incrustaciones calcáreas (comúnmente denominadas como cal).
La presencia de bicarbonatos en el agua hace que, cuando se calienta el agua dura, se formen precipitados de carbonato cálcico que dan lugar a las llamadas costras calcáreas.
Este carbonato cálcico (cal), aparte de suponer un problema en la limpieza, debido a los restos en lavabos, mamparas, etc, supone un gran inconveniente para calderas, torres de enfriamiento y otros equipos que utilizen agua caliente.
Estas costras calcáreas se pueden eliminar provocando la reacción química inversa a la anterior, es decir, que forme nuevamente calcio soluble y bicarbonato. Esto se consigue, por ejemplo, añadiendo un exceso de dióxido de carbono o un ácido débil, como ácido acético (vinagre) o ácido cítrico (zumo de limón). Muchos preparados de limpieza para eliminar la cal se basan, de hecho, en un pH ligeramente ácido.
Es importante conocer la dureza del agua de abastecimiento de nuestra localidad, ya que ese dato nos permite ajustar el funcionamiento de determinados electrodomésticos que ofrecen dicha posibilidad (sobre todo lavadoras y lavavajillas). Esta regulación previa del aparato permitirá que se operen cambios en el funcionamiento del mismo en función del valor seleccionado y de este modo se compensen los efectos negativos que un agua de elevada dureza puede provocar, con el consiguiente mejor funcionamiento y mayor duración del electrodoméstico.
Clasificación de la dureza del agua (º H F):
– < 7: agua muy blanda
– 7-14: agua blanda
– 14-32: agua de dureza intermedia
– 32-54: agua dura
– > 54: agua muy dura
¿CÓMO PODEMOS ELIMINAR LA DUREZA DEL AGUA?
Depende de si ésta es temporal o permanente.
En caso de dureza temporal, basta con calentar el agua hasta la ebullición para que precipiten el carbonato de calcio y el hidróxido de magnesio. Después se hace una filtración para que desaparezcan los iones de disolución y habrá disminuído de forma considerable la dureza.
Para eliminar la dureza permanente se utilizan las resinas intercambiadoras de iones ( Descalcificadores).